In een samenwerkingsverband van de afdeling Oogheelkunde van het Maastrichtse universitair ziekenhuis en het expertisecentrum NeMO expertisecentrum wordt er gezocht naar biomarkers voor mitochondriële aandoeningen.
Onderstaand verslag van René de Coo, aangaande dit onderwerp, werd onlangs gepubliceerd in de nieuwsbrief van Stichting Cure ADOA Foundation. Hier is René de Coo één van de leden van de medisch adviesraad.
Wat zijn biomarkers? Kun je daar wat aan hebben voor mitochondriële aandoeningen? Zijn ze van belang voor ADOA?
Biomarkers zijn biologische markeerders, oftewel aanwijspunten. Een vergelijking: als je wilt weten of je genoeg benzine in de tank van je auto hebt, kijk je of het metertje groen is, dan is de tank voldoende vol; bij oranje moet je een pompstation zoeken en rood waarschuwt dat je stil komt te staan (of je staat al stil).
Een biomarker voor een mitochondriële ziekte zou je in de ideale situatie moeten kunnen vertellen of je wel of niet een aandoening hebt en liefst ook nog of je het mild, matig of ernstig hebt.
Vanuit het gezichtspunt van de patiënt zul je je wellicht afvragen wat je daarmee opschiet. Van een biomarker word je niet beter. Als onderzoeker echter ben je bezig om een therapie te ontwikkelen voor een aandoening. Om te weten of een mogelijke therapie werkt, heb je een gevoelige meetschaal nodig. Soms is het niet duidelijk of wat je aan het proberen bent, het gewenste effect heeft. In het ideale geval kan zo’n biomarker aangeven of je de meter richting het groene deel of richting het rode deel van de meetschaal duwt. Liefst signaleer je dat eerder dan de patiënt zelf.
Kortom, de biomarker kan heel nuttig zijn bij het versnellen van het ontwikkelproces van een geneesmiddel of andere vorm van therapie.
De belangstelling voor biomarkers is recent toegenomen, omdat er enkele in bloed te bepalen stoffen ontdekt zijn die bij mensen met een energiestoornis van de spieren als biomarker kunnen fungeren.
Voor ADOA, LHON en ook voor een aandoening als glaucoom, waar mogelijk ook mitochondriën een rol bij het ziekteproces spelen, kennen we deze biomarkers (nog) niet.
Met geavanceerd onderzoek proberen we in bloed te speuren naar biomarkers die zowel makkelijk te bepalen zijn als ons heldere informatie geven.
Bij ADOA zou een biomarker kunnen helpen om medicijnen gemakkelijker te kunnen testen en volgen voor hun positieve maar ook negatieve effecten op het tot uiting komen en het beloop van het ziektebeeld.
In de komende twee jaar hopen we stappen op dit gebied te kunnen maken.








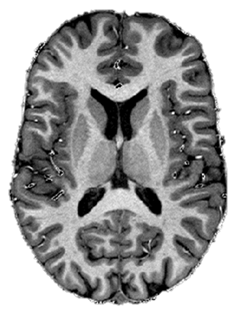 Een groep binnen de Universiteit Maastricht is momenteel bezig met een onderzoek naar de invloed van fouten in POLG op de werking van de hersenen. In dit onderzoek maken ze afbeeldingen van de hersenen met behulp van een krachtige MRI-scanner. De scans geven inzicht in verschillende eigenschappen van de hersenen, zoals structuur, activiteit en doorbloeding. Ze verwachten dat dragers (mensen met een fout in één POLG kopie), mogelijk als gevolg van een licht energietekort, kleine veranderingen in hersenprocessen en hersenactiviteit vertonen. Door deze veranderingen te achterhalen hopen ze de ontwikkeling van ziekte beter te leren begrijpen.
Een groep binnen de Universiteit Maastricht is momenteel bezig met een onderzoek naar de invloed van fouten in POLG op de werking van de hersenen. In dit onderzoek maken ze afbeeldingen van de hersenen met behulp van een krachtige MRI-scanner. De scans geven inzicht in verschillende eigenschappen van de hersenen, zoals structuur, activiteit en doorbloeding. Ze verwachten dat dragers (mensen met een fout in één POLG kopie), mogelijk als gevolg van een licht energietekort, kleine veranderingen in hersenprocessen en hersenactiviteit vertonen. Door deze veranderingen te achterhalen hopen ze de ontwikkeling van ziekte beter te leren begrijpen. 



